| Cat. # | Size | Price | Inventory |
|---|---|---|---|
| 56383S | 1 Kit (24 immunoprecipitations) |
| Product Includes | Volume (with Count) | Storage Temp | |||
|---|---|---|---|---|---|
| Glycine Solution (10X) 7005 | 1 x 100 ml | +4°C | |||
| ChIP Sonication Cell Lysis Buffer (2X) | 1 x 21 ml | +4°C | |||
| ChIP Sonication Nuclear Lysis Buffer | 1 x 21 ml | +4°C | |||
| ChIP Buffer (10X) | 1 x 20 ml | +4°C | |||
| ChIP Elution Buffer (2X) | 1 x 2.5 ml | +4°C | |||
| 5 M NaCl | 1 x 3 ml | +4°C | |||
| ChIP-Grade Protein G Magnetic Beads 9006 | 1 x 780 µl | +4°C | |||
| Protease Inhibitor Cocktail (200X) 7012 | 1 x 750 µl | -20°C | |||
| RNAse A (10 mg/ml) 7013 | 1 x 50 µl | -20°C | |||
| Proteinase K (20 mg/ml) 10012 | 1 x 100 µl | -20°C | |||
| SimpleChIP® Human RPL30 Exon 3 Primers 7014 | 1 x 150 µl | -20°C | |||
| SimpleChIP® Mouse RPL30 Intron 2 Primers 7015 | 1 x 150 µl | -20°C | |||
| Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) 4620 | 1 x 100 µl | -20°C | |||
| Normal Rabbit IgG 2729 | 1 x 50 µl | -20°C | |||
| DNA Binding Buffer | 1 x 30 ml | RT | |||
| DNA Wash Buffer (add 4x volume ethanol before use) | 1 x 6 ml | RT | |||
| DNA Elution Buffer | 2 x 1 ml | RT | |||
| DNA Purification Columns and Collection Tubes | 1 x 30 Pack | RT |
Product Information
Specific for product: SimpleChIP® Plus Sonication Chromatin IP Kit #56383.
Reagents Included:
Reagents Not Included:
| ! | This ! signifies an important step in the protocol regarding volume changes based on the number of immunoprecipitation preparations (IP preps). One IP prep is defined as 4 x 106 tissue cultured cells or 25 mg or disaggregated tissue. |
| !! | This !! signifies an important step to dilute a buffer before proceeding. |
| SAFE STOP | This is a safe stopping point in the protocol, if stopping is necessary. |
When harvesting tissue, remove unwanted material from the sample, such as fat and necrotic material. Tissue can be processed and cross-linked immediately or frozen on dry ice for processing later. For optimal ChIP results, use 25 mg of tissue for each immunoprecipitation to be performed. An additional 5 mg of tissue should be processed for Analysis of Chromatin Digestion and Concentration and for use as input chromatin (Section IV). The chromatin yield does vary between tissue types, and some tissues may require more than 25 mg for each immunoprecipitation.
One chromatin preparation is defined as 100 to 150 mg of tissue. This recommended amount of tissue accounts for potential low yield with some tissue types and also ensures efficient chromatin fragmentation during sonication. Please see Appendix A for more information regarding the expected chromatin yield for different types of tissue.
Before starting:
(!) All buffer volumes should be increased proportionally based on the number of chromatin preps in the experiment.
For optimal ChIP results, use approximately 4 x 106 cells for each immunoprecipitation to be performed. For HCT 116 cells, this is equivalent to 1/3 of a 15 cm culture dish containing cells that are 90% confluent in 20 ml of growth medium. An additional 1 x 106 cells should be processed for Analysis of Chromatin Digestion and Concentration and for use as input chromatin (Section IV).
One chromatin preparation is defined as 1 x 107 to 2 x 107 cells. This recommended cell number accounts for potential low yield with some cell types and also ensures efficient chromatin fragmentation during sonication.
Before starting:
(!) All buffer volumes should be increased proportionally based on the number of 15 cm tissue culture dishes (or 20 ml suspension cells) used in the experiment.
One chromatin preparation is defined as 100 to 150 mg of tissue or 1 x 107to 2 x 107tissue culture cells. Multiple chromatin preparations can be performed simultaneously, as long as the amounts of buffers are scaled appropriately and sonication is performed on 1 ml samples. The number of cells and volume of sample used for sonication is critical for generation of appropriately sized chromatin fragments.
Before starting:
(!) All buffer volumes should be increased proportionally based on the number of chromatin preps in the experiment.
For optimal ChIP results, use approximately 5 to 10 µg of sonicated, cross-linked chromatin (as determined in Section IV) per immunoprecipitation. This should be roughly equivalent to a single 100 µl IP prep from 25 mg of disaggregated tissue or 4x106 tissue culture cells. Typically, 100 µl of digested chromatin is diluted into 400 µl 1X ChIP Buffer prior to the addition of antibodies. However, if more than 100 µl of chromatin is required per IP, the cross-linked chromatin preparation must be diluted into 1X ChIP buffer at a dilution ratio of 1:4. No additional protein G magnetic beads are necessary in this case, although prolonged incubation time with beads is helpful.
Before starting:
(!) All buffer volumes should be increased proportionally based on the number of immunoprecipitations in the experiment.
NOTE: Most antibodies from Cell Signaling Technology work optimally between 1 and 2 µg per IP sample. In the case where there are multiple samples with varying concentrations, it is best to match the negative control Normal Rabbit IgG #2729 to the highest antibody concentration.
Before starting:
(!) All buffer volumes should be increased proportionally based on the number of immunoprecipitations in the experiment.
Before starting:
Recommendations:
| Primer length: | 24 nucleotides |
| Optimum Tm: | 60°C |
| Optimum GC: | 50% |
| Amplicon size: | 150 to 200 bp (for standard PCR) |
| 80 to 160 bp (for real-time quantitative PCR) |
Standard PCR Method:
| Reagent | Volume for 1 PCR Reaction (18 µl) |
|---|---|
| Nuclease-free H2O | 12.5 µl |
| 10X PCR Buffer | 2.0 µl |
| 4 mM dNTP Mix | 1.0 µl |
| 5 µM RPL30 Primers | 2.0 µl |
| Taq DNA Polymerase | 0.5 µl |
Real-Time Quantitative PCR Method:
| Reagent | Volume for 1 PCR Reaction (18 µl) |
|---|---|
| Nuclease-free H2O | 6 µl |
| 5 µM RPL30 Primers | 2 µl |
| SimpleChIP® Universal qPCR Master Mix #88989 | 10 µl |
| a. | Initial Denaturation | 95°C 3 min |
| b. | Denature | 95°C 15 sec |
| c. | Anneal and Extension: | 60°C 60 sec |
| d. | Repeat steps b and c for a total of 40 cycles. |
Percent Input = 2% x 2(C[T] 2%Input Sample - C[T] IP Sample)
C[T] = CT = Average threshold cycle of PCR reaction
The immuno-enriched DNA samples prepared with this kit are directly compatible with ChIP-seq. For downstream NG-sequencing DNA library construction, use a DNA library preparation protocol or kit compatible with your downstream sequencing platform. For sequencing on Illumina® platforms, we recommend DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 and its associated index primers Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 or Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538.
Recommendations:
When harvesting cross-linked chromatin from tissue samples, the yield of chromatin can vary significantly between tissue types. The table to the right provides a range for the expected yield of chromatin from 100 mg of tissue compared to 2 x 107 HCT 116 cells, and the expected DNA concentration, as determined in Section IV of the protocol. For optimal ChIP results, we recommend DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 and its associated index primers Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 or Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538.
| Tissue/Cell | Total Chromatin Yield | Expected DNA Concentration |
|---|---|---|
| Liver | 50 µg per 100 mg tissue | 150 µg/ml |
| Brain | 25 µg per 100 mg tissue | 50 µg/ml |
| Heart | 105 µg per 100 mg tissue | 20 µg/ml |
| HCT 116 | 100-150 µg per 2 x 107 cells | 100-150 µg/ml |
Transcription factors and cofactors bind to chromatin DNA more loosely than histone proteins. As a result, they tend to dissociate from chromatin during sonication. Additional fixation time can result in increased capture of transcription factors and cofactors in the ChIP assay, especially with tissue samples. As shown in Figure 7, increasing the fixation time from 10 min to 30 min may reduce chromatin fragmentation size (left panel), but it significantly enhances enrichment of both cofactors RING1B and SUZ12 in heart tissue, as indicated by ChIP-qPCR (middle and right panels).
Typically, 10 min fixation is sufficient for histone modification ChIP with both cell and tissue samples, whereas transcription factors and cofactors may require additional fixation up to 30 min, especially with tissue samples.
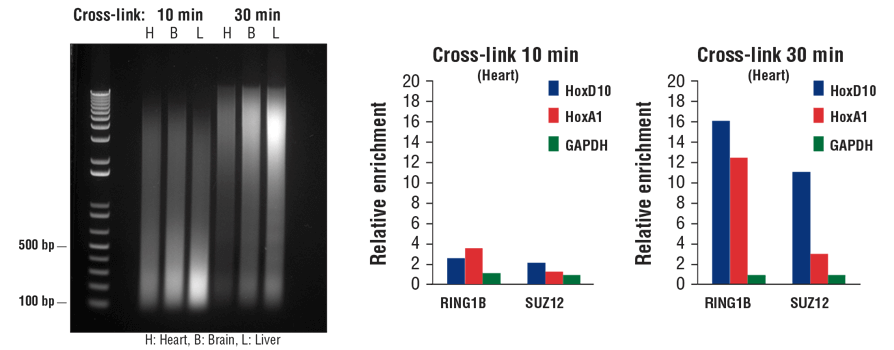
FIGURE 7. Mouse heart (H), brain (B), and liver (L) were cross-linked for 10 min or 30 min, as indicated (left panel). The chromatin was prepared and sonicated, DNA was purified and separated by electrophoresis on a 1% agarose gel. In the ChIP-qPCR assay (middle and right panels), chromatin immunoprecipitations were performed with either RING1B (D22F2) XP® Rabbit mAb #5694 or SUZ12 (D39F6) XP® Rabbit mAb #3737. The enriched DNA was quantified by real-time PCR using SimpleChIP® Mouse HoxD10 Exon 1 Primers #7429, SimpleChIP® Mouse HoxA1 Promoter Primers #7341, and SimpleChIP® Mouse GAPDH Intron 2 Primers #8986. The amount of immunoprecipitated DNA in each sample is represented as normalized signal to the negative GAPDH locus (equivalent to one).
Optimal conditions for the fragmentation of cross-linked chromatin DNA is highly dependent on the number of cells, volume of sample, length of sonication, and sonicator power setting used. For each sonication sample, we recommend using 100-150 mg of tissue or 1 x 107 to 2 x 107 cells per 1 ml ChIP Sonication Nuclear Lysis Buffer. Below is a protocol for determination of the optimal sonication conditions for a specific tissue or cell type.
NOTE: Optimal sonication conditions can vary with different sample types and fixation times. Use the minimal number of sonication cycles required to generate the desired length of chromatin fragments. Over sonication, as indicated by more than 80% of total DNA fragments less than 500 bp, can result in excessive damage to the chromatin and result in lower immunoprecipitation efficiency (see Figure 8, right panel).
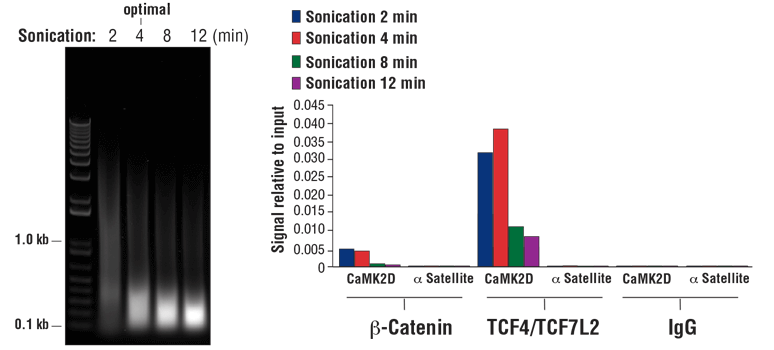
FIGURE 8. HCT 116 cells were cross-linked for 10 min and sonicated for the time indicated (left panel). DNA was purified as described in Section IV of the SimpleChIP® Plus Sonication Chromatin IP Kit #56383, and 20 µl of purified DNA was separated by electrophoresis on a 1% agarose gel. As shown in the left panel, increasing cycles of sonication reduces the size of chromatin fragments. Chromatin immunoprecipitations were performed with either Non-phospho (Active) Β-Catenin (Ser33/37/Thr41) (D13A1) Rabbit mAb #8814, TCF4/TCF7L2 (C48H11) Rabbit mAb #2569, or Normal Rabbit IgG #2729 using SimpleChIP® Plus Sonication Chromatin IP Kit #56383. The enriched DNA was quantified by real-time PCR using SimpleChIP® Human CaMK2D Intron 3 Primers #5111 and SimpleChIP® Human α Satellite Repeat Primers #4486. The amount of immunoprecipitated DNA in each sample is represented as signal relative to the total amount of input chromatin (equivalent to 100%; right panel). As shown, 4 min of chromatin sonication is optimal when using a Branson Digital Sonifier D250 probe sonicator with a 1/8 inch Micro Tip. Over-sonication significantly impairs enrichment of both cofactor beta-catenin and transcription factor TCF4/TCF7L2 containing chromatin.
| Problem | Possible Causes | Recommendation |
|---|---|---|
| 1. Concentration of the fragmented chromatin is too low. |
Cell/nuclear lysis is incomplete. Not enough cells were used for the chromatin preparation. |
If DNA concentration of the chromatin preparation is close to 50 µg/ml, add additional chromatin to each IP to give at least 5 µg/IP and continue with protocol. Count a separate plate of cells before cross-linking to determine an accurate cell number. |
| 2. Chromatin is under-fragmented and fragments are too large (>50% above 1.5kb). |
Cells may have been over cross-linked. Too many cells/tissues were processed. |
Shorten the crosslinking time within 10-30 minute range. Reduce the amount of cell/tissues per sonication. Conduct sonication time course. |
| 3. Chromatin is over-fragmented (>90% under 300 bp). |
Sonication condition is too harsh. |
Conduct a sonication time course to find a minimum output/duration to achieve appropriate sonication. |
| 4. No product or very little product in the input PCR reactions. |
Not enough DNA added to the PCR reaction or conditions are not optimal. PCR amplified region may span nucleosome-free region. Not enough chromatin added to the IP or chromatin is over-sonicated |
Add more DNA to the PCR reaction or increase the number of amplification cycles. Optimize the PCR conditions for experimental primer set using purified DNA from cross-linked and sonicated chromatin. For optimal ChIP results add 5-10 µg chromatin per IP. See recommendations for problems 1 and 3 above. |
| 5. No product in the positive control Histone H3-IP RPL30 PCR reaction. |
Not enough chromatin or antibody added to the IP reaction or IP incubation time is too short. Incomplete elution of chromatin from Protein G beads. |
Be sure to add 5-10 µg of chromatin and 10 µl of antibody to each IP reaction and incubate with antibody over-night and an additional 2 hr after adding Protein G beads. Elution of chromatin from Protein G beads is optimal at 65°C with frequent mixing to keep beads suspended in solution. |
| 6. Quantity of product in the negative control Rabbit IgG-IP and positive control Histone H3-IP PCR reactions is equivalent. |
Too much or not enough chromatin added to the IP reaction. Alternatively, too much antibody added to the IP reaction. Too much DNA added to the PCR reaction or too many cycles of amplification. |
Add no more than 15 µg of chromatin and 10 µl of histone H3 antibody to each IP reaction. Reduce the amount of normal rabbit IgG to 1 µl per IP. Add less DNA to the PCR reaction or decrease the number of PCR cycles. It is very important that the PCR products are analyzed within the linear amplification phase of PCR. Otherwise, the differences in quantities of starting DNA cannot be accurately measured. |
| 7. No product in the Experimental Antibody-IP PCR reaction. |
Not enough DNA added to the PCR reaction. Not enough antibody added to the IP reaction. Antibody does not work for IP. |
Add more DNA to the PCR reaction or increase the number of amplification cycles. Typically a range of 1 to 5 µg of antibody is added to the IP reaction; however, the exact amount depends greatly on the individual antibody. Increase the amount of antibody added to the IP. Find an alternate antibody source. |
posted March 2017
revised April 2022
Protocol Id: 1384
Specific for product: SimpleChIP® Plus Sonication Chromatin IP Kit #56383.
When harvesting tissue, remove unwanted material from the sample, such as fat and necrotic material. Tissue can be processed and cross-linked immediately or frozen on dry ice for processing later. For optimal ChIP results, use 25 mg of tissue for each immunoprecipitation to be performed. An additional 5 mg of tissue should be processed for Analysis of Chromatin Digestion and Concentration and for use as input chromatin (Section IV). The chromatin yield does vary between tissue types, and some tissues may require more than 25 mg for each immunoprecipitation.
One chromatin preparation is defined as 100 to 150 mg of tissue. This recommended amount of tissue accounts for potential low yield with some tissue types and also ensures efficient chromatin fragmentation during sonication. Please see Appendix A for more information regarding the expected chromatin yield for different types of tissue.
Before starting:
For optimal ChIP results, use approximately 4 x 106 cells for each immunoprecipitation to be performed. For HCT 116 cells, this is equivalent to 1/3 of a 15 cm culture dish containing cells that are 90% confluent in 20 ml of growth medium. An additional 1 x 106 cells should be processed for Analysis of Chromatin Digestion and Concentration and for use as input chromatin (Section IV).
One chromatin preparation is defined as 1 x 107 to 2 x 107 cells. This recommended cell number accounts for potential low yield with some cell types and also ensures efficient chromatin fragmentation during sonication.
Before starting:
One chromatin preparation is defined as 100 to 150 mg of tissue or 1 x 107to 2 x 107tissue culture cells. Multiple chromatin preparations can be performed simultaneously, as long as the amounts of buffers are scaled appropriately and sonication is performed on 1 ml samples. The number of cells and volume of sample used for sonication is critical for generation of appropriately sized chromatin fragments.
Before starting:
For optimal ChIP results, use approximately 5 to 10 µg of sonicated, cross-linked chromatin (as determined in Section IV) per immunoprecipitation. This should be roughly equivalent to a single 100 µl IP prep from 25 mg of disaggregated tissue or 4x106 tissue culture cells. Typically, 100 µl of digested chromatin is diluted into 400 µl 1X ChIP Buffer prior to the addition of antibodies. However, if more than 100 µl of chromatin is required per IP, the cross-linked chromatin preparation must be diluted into 1X ChIP buffer at a dilution ratio of 1:4. No additional protein G magnetic beads are necessary in this case, although prolonged incubation time with beads is helpful.
Before starting:
NOTE: Most antibodies from Cell Signaling Technology work optimally between 1 and 2 µg per IP sample. In the case where there are multiple samples with varying concentrations, it is best to match the negative control Normal Rabbit IgG #2729 to the highest antibody concentration.
Before starting:
Before starting:
Recommendations:
| Primer length: | 24 nucleotides |
| Optimum Tm: | 60°C |
| Optimum GC: | 50% |
| Amplicon size: | 150 to 200 bp (for standard PCR) |
| 80 to 160 bp (for real-time quantitative PCR) |
Standard PCR Method:
| Reagent | Volume for 1 PCR Reaction (18 µl) |
|---|---|
| Nuclease-free H2O | 12.5 µl |
| 10X PCR Buffer | 2.0 µl |
| 4 mM dNTP Mix | 1.0 µl |
| 5 µM RPL30 Primers | 2.0 µl |
| Taq DNA Polymerase | 0.5 µl |
Real-Time Quantitative PCR Method:
| Nuclease-free H2O | 6 µl |
| 5 µM RPL30 Primers | 2 µl |
| SimpleChIP® Universal qPCR Master Mix #88989 | 10 µl |
| a. | Initial Denaturation | 95°C 3 min |
| b. | Denature | 95°C 15 sec |
| c. | Anneal and Extension: | 60°C 60 sec |
| d. | Repeat steps b and c for a total of 40 cycles. |
Percent Input = 2% x 2(C[T] 2%Input Sample - C[T] IP Sample)
C[T] = CT = Average threshold cycle of PCR reaction
The immuno-enriched DNA samples prepared with this kit are directly compatible with ChIP-seq. For downstream NG-sequencing DNA library construction, use a DNA library preparation protocol or kit compatible with your downstream sequencing platform. For sequencing on Illumina® platforms, we recommend DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 and its associated index primers Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 or Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538.
Recommendations:
When harvesting cross-linked chromatin from tissue samples, the yield of chromatin can vary significantly between tissue types. The table to the right provides a range for the expected yield of chromatin from 100 mg of tissue compared to 2 x 107 HCT 116 cells, and the expected DNA concentration, as determined in Section IV of the protocol. For optimal ChIP results, we recommend DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 and its associated index primers Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 or Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538.
| Tissue/Cell | Total Chromatin Yield | Expected DNA Concentration |
|---|---|---|
| Liver | 50 µg per 100 mg tissue | 150 µg/ml |
| Brain | 25 µg per 100 mg tissue | 50 µg/ml |
| Heart | 105 µg per 100 mg tissue | 20 µg/ml |
| HCT 116 | 100-150 µg per 2 x 107 cells | 100-150 µg/ml |
Transcription factors and cofactors bind to chromatin DNA more loosely than histone proteins. As a result, they tend to dissociate from chromatin during sonication. Additional fixation time can result in increased capture of transcription factors and cofactors in the ChIP assay, especially with tissue samples. As shown in Figure 7, increasing the fixation time from 10 min to 30 min may reduce chromatin fragmentation size (left panel), but it significantly enhances enrichment of both cofactors RING1B and SUZ12 in heart tissue, as indicated by ChIP-qPCR (middle and right panels).
Typically, 10 min fixation is sufficient for histone modification ChIP with both cell and tissue samples, whereas transcription factors and cofactors may require additional fixation up to 30 min, especially with tissue samples.

FIGURE 7. Mouse heart (H), brain (B), and liver (L) were cross-linked for 10 min or 30 min, as indicated (left panel). The chromatin was prepared and sonicated, DNA was purified and 20 µl was separated by electrophoresis on a 1% agarose gel. In the ChIP-qPCR assay (middle and right panels), chromatin immunoprecipitations were performed with either 10 µl of RING1B (D22F2) XP® Rabbit mAb #5694 or 5 µl of SUZ12 (D39F6) XP® Rabbit mAb #3737. The enriched DNA was quantified by real-time PCR using SimpleChIP® Mouse HoxD10 Exon 1 Primers #7429, SimpleChIP® Mouse HoxA1 Promoter Primers #7341, and SimpleChIP® Mouse GAPDH Intron 2 Primers #8986. The amount of immunoprecipitated DNA in each sample is represented as normalized signal to the negative GAPDH locus (equivalent to one).
Optimal conditions for the fragmentation of cross-linked chromatin DNA is highly dependent on the number of cells, volume of sample, length of sonication, and sonicator power setting used. For each sonication sample, we recommend using 100-150 mg of tissue or 1 x 107 to 2 x 107 cells per 1 ml ChIP Sonication Nuclear Lysis Buffer. Below is a protocol for determination of the optimal sonication conditions for a specific tissue or cell type.
NOTE: Optimal sonication conditions can vary with different sample types and fixation times. Use the minimal number of sonication cycles required to generate the desired length of chromatin fragments. Over sonication, as indicated by more than 80% of total DNA fragments less than 500 bp, can result in excessive damage to the chromatin and result in lower immunoprecipitation efficiency (see Figure 8, right panel).

FIGURE 8. Chromatin immunoprecipitations were performed with 2 x 107 HCT 116 cells that were cross-linked for 10 min and sonicated for the time indicated (left panel). DNA was purified as described in Section IV of the SimpleChIP® Plus Sonication Chromatin IP Kit #56383, and 20 µl of purified DNA was separated by electrophoresis on a 1% agarose gel. As shown in the left panel, increasing cycles of sonication reduces the size of chromatin fragments. Chromatin immunoprecipitations were performed with either 5 µl of Non-phospho (Active) Β-Catenin (Ser33/37/Thr41) (D13A1) Rabbit mAb #8814, 10 µl of TCF4/TCF7L2 (C48H11) Rabbit mAb #2569, or 2 µl of Normal Rabbit IgG #2729 using SimpleChIP® Plus Sonication Chromatin IP Kit #56383. The enriched DNA was quantified by real-time PCR using SimpleChIP® Human CaMK2D Intron 3 Primers #5111 and SimpleChIP® Human α Satellite Repeat Primers #4486. The amount of immunoprecipitated DNA in each sample is represented as signal relative to the total amount of input chromatin (equivalent to one; right panel). As shown, 4 min of chromatin sonication is optimal when using a Branson Digital Sonifier D250 probe sonicator with a 1/8 inch Micro Tip. Over-sonication significantly impairs enrichment of both cofactor beta-catenin and transcription factor TCF4/TCF7L2 containing chromatin.
| Problem | Possible Causes | Recommendation |
|---|---|---|
| 1. Concentration of the fragmented chromatin is too low. |
Cell/nuclear lysis is incomplete. Not enough cells were used for the chromatin preparation. |
If DNA concentration of the chromatin preparation is close to 50 µg/ml, add additional chromatin to each IP to give at least 5 µg/IP and continue with protocol. Count a separate plate of cells before cross-linking to determine an accurate cell number. |
| 2. Chromatin is under-fragmented and fragments are too large (>50% above 1.5kb). |
Cells may have been over cross-linked. Too many cells/tissues were processed. |
Shorten the crosslinking time within 10-30 minute range. Reduce the amount of cell/tissues per sonication. Conduct sonication time course. |
| 3. Chromatin is over-fragmented (>90% under 300 bp). |
Sonication condition is too harsh. |
Conduct a sonication time course to find a minimum output/duration to achieve appropriate sonication. |
| 4. No product or very little product in the input PCR reactions. |
Not enough DNA added to the PCR reaction or conditions are not optimal. PCR amplified region may span nucleosome-free region. Not enough chromatin added to the IP or chromatin is over-sonicated |
Add more DNA to the PCR reaction or increase the number of amplification cycles. Optimize the PCR conditions for experimental primer set using purified DNA from cross-linked and sonicated chromatin. For optimal ChIP results add 5-10 µg chromatin per IP. See recommendations for problems 1 and 3 above. |
| 5. No product in the positive control Histone H3-IP RPL30 PCR reaction. |
Not enough chromatin or antibody added to the IP reaction or IP incubation time is too short. Incomplete elution of chromatin from Protein G beads. |
Be sure to add 5-10 µg of chromatin and 10 µl of antibody to each IP reaction and incubate with antibody over-night and an additional 2 hr after adding Protein G beads. Elution of chromatin from Protein G beads is optimal at 65°C with frequent mixing to keep beads suspended in solution. |
| 6. Quantity of product in the negative control Rabbit IgG-IP and positive control Histone H3-IP PCR reactions is equivalent. |
Too much or not enough chromatin added to the IP reaction. Alternatively, too much antibody added to the IP reaction. Too much DNA added to the PCR reaction or too many cycles of amplification. |
Add no more than 15 µg of chromatin and 10 µl of histone H3 antibody to each IP reaction. Reduce the amount of normal rabbit IgG to 1 µl per IP. Add less DNA to the PCR reaction or decrease the number of PCR cycles. It is very important that the PCR products are analyzed within the linear amplification phase of PCR. Otherwise, the differences in quantities of starting DNA cannot be accurately measured. |
| 7. No product in the Experimental Antibody-IP PCR reaction. |
Not enough DNA added to the PCR reaction. Not enough antibody added to the IP reaction. Antibody does not work for IP. |
Add more DNA to the PCR reaction or increase the number of amplification cycles. Typically a range of 1 to 5 µg of antibody is added to the IP reaction; however, the exact amount depends greatly on the individual antibody. Increase the amount of antibody added to the IP. Find an alternate antibody source. |
posted March 2017
revised April 2022
Protocol Id: 1404
The chromatin immunoprecipitation (ChIP) assay is a powerful and versatile technique used for probing protein-DNA interactions within the natural chromatin context of the cell (1,2). This assay can be used to identify multiple proteins associated with a specific region of the genome, or the opposite, to identify the many regions of the genome bound by a particular protein (3-6). It can be used to determine the specific order of recruitment of various proteins to a gene promoter or to "measure" the relative amount of a particular histone modification across an entire gene locus (3,4). In addition to histone proteins, the ChIP assay can be used to analyze binding of transcription factors and co-factors, DNA replication factors and DNA repair proteins. When performing the ChIP assay, cells or tissues are first fixed with formaldehyde, a reversible protein-DNA cross-linking agent that "preserves" the protein-DNA interactions occurring in the cell (1,2). Cells are lysed and chromatin is harvested and fragmented using either sonication or enzymatic digestion. The chromatin is then immunoprecipitated with antibodies specific to a particular protein or histone modification. Any DNA sequences that are associated with the protein or histone modification of interest will co-precipitate as part of the cross-linked chromatin complex and the relative amount of that DNA sequence will be enriched by the immunoselection process. After immunoprecipitation, the protein-DNA cross-links are reversed and the DNA is purified. Standard PCR or Quantitative Real-Time PCR can be used to measure the amount of enrichment of a particular DNA sequence by a protein-specific immunoprecipitation (1,2). Alternatively, the ChIP assay can be combined with genomic tiling micro-array (ChIP on chip) techniques, high throughput sequencing, or cloning strategies, all of which allow for genome-wide analysis of protein-DNA interactions and histone modifications (5-8).
Except as otherwise expressly agreed in a writing signed by a legally authorized representative of CST, the following terms apply to Products provided by CST, its affiliates or its distributors. Any Customer's terms and conditions that are in addition to, or different from, those contained herein, unless separately accepted in writing by a legally authorized representative of CST, are rejected and are of no force or effect.
Products are labeled with For Research Use Only or a similar labeling statement and have not been approved, cleared, or licensed by the FDA or other regulatory foreign or domestic entity, for any purpose. Customer shall not use any Product for any diagnostic or therapeutic purpose, or otherwise in any manner that conflicts with its labeling statement. Products sold or licensed by CST are provided for Customer as the end-user and solely for research and development uses. Any use of Product for diagnostic, prophylactic or therapeutic purposes, or any purchase of Product for resale (alone or as a component) or other commercial purpose, requires a separate license from CST. Customer shall (a) not sell, license, loan, donate or otherwise transfer or make available any Product to any third party, whether alone or in combination with other materials, or use the Products to manufacture any commercial products, (b) not copy, modify, reverse engineer, decompile, disassemble or otherwise attempt to discover the underlying structure or technology of the Products, or use the Products for the purpose of developing any products or services that would compete with CST products or services, (c) not alter or remove from the Products any trademarks, trade names, logos, patent or copyright notices or markings, (d) use the Products solely in accordance with CST Product Terms of Sale and any applicable documentation, and (e) comply with any license, terms of service or similar agreement with respect to any third party products or services used by Customer in connection with the Products.