您可以通过点击 CST 信号转导通路图的各个节点查找研究资源或产品信息。您还可以下载通路图,将其用于教育和研究。
凋亡是一种严格受控的细胞死亡模式,对于多细胞生物的正常生长和发育不可或缺。凋亡缺陷会导致异常发育与发病。
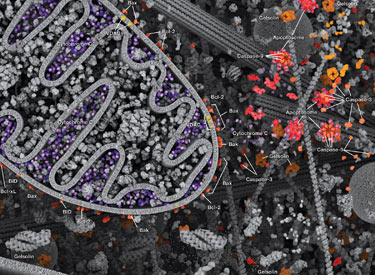
在程序性蛋白水解级联过程中,特定氨基酸残基上的 Caspase 剪切靶标蛋白。凋亡信号触发 caspase 活化,包括大 (p20)、小 (p10) caspase 结构域的剪切及随后的再连接,以及一个氨基末端前结构域的去除。哺乳动物的 caspase 可根据结构、分子功能和底物偏好进行分类。Caspase-2、-8、-9、-10 以及 -12 被称为“启动型 caspase”,因为它们与上游促凋亡信号结合得十分紧密。启动型 caspase 剪切并激活下游效应因子或者“执行型” caspase-3、-6 和 -7,这些执行型 caspase 会导致最终负责程序性细胞死亡的蛋白质发生改变。PARP 和核纤层蛋白 A/C (lamin A/C) 等靶蛋白可被执行型 caspase 剪切,而后成为凋亡的标记。Caspase 可以受到凋亡抑制因子 (IAP) 蛋白(c-IAP1/2、XIAP、livin、survivin)的抑制。这些蛋白通过直接结合或者作为泛素连接酶,靶定 caspase ,通过泛素化降解,来限制 caspase 活性。IAP 蛋白与 IAP 抑制剂 (Smac/Diablo) 之间的相互作用消除了 IAP 介导的 caspase 抑制,从而促进凋亡。
内部控制凋亡,需要通过释放线粒体的 cytochrome c 来激活胞质 caspase,而且需要通过 Bcl-2 家族蛋白来调控线粒体外膜透化。能够促进细胞死亡的 Bcl-2 蛋白包括那些含有多重 BH 结构域(例如:Bax、Bak)或者含有单个 BH3 序列(Bad、Bik、Bid、Puma、Bim、Bmf 和 Noxa)的蛋白。能够促进存活的多重 BH 结构域 Bcl-2 蛋白包括 Bcl-2、Bcl-xL 和 Bcl-w。促凋亡的 Bax 和 Bak 在线粒体上寡聚,从而改变膜通透性并允许 cytochrome c 释放至胞浆中。抗凋亡的 Bcl-xL 与膜结合的 Bax 竞争结合,促进其从线粒体膜上去除的过程。“BH3 only” 蛋白是凋亡的重要调节分子,能够通过抑制抗凋亡蛋白以及促进 Bax 和 Bak 嵌入线粒体外膜来促进细胞死亡。Bcl-2 家族蛋白活性常常通过磷酸化进行调控。Bad 的磷酸化能够防止 Bad 与抗凋亡的 Bcl-2 和 Bcl-xL 蛋白之间的相互作用。促凋亡的 Bim 磷酸化会导致 Bim 的泛素介导降解,以及减少对抗凋亡的 Bcl-2 和 Bcl-xL 蛋白的抑制。对 DNA 损伤做出反应的 Bid 磷酸化能够防止其活化,并促进 DNA 修复与细胞存活通路。
Fas、TNFαR、DR3、DR4 和 DR5 等死亡受体被各自的配体激活后,可诱发凋亡外源性通路。死亡受体配体通过受体寡聚化,启动信号转导,从而导致特异的接头蛋白的募集,以及 caspase 级联反应的激活。FasL 的结合通过接头蛋白 FADD 募集启动型 caspase-8。激活的 caspase-8 可通过 2 条并行级联反应诱发凋亡:它既可以直接剪切并激活 caspase-3,也可以剪切 Bcl-2 家族的促凋亡蛋白 Bid。切短的 Bid (tBid) 转位到线粒体中,诱导 cytochrome C 释放,从而激活 caspase-9 和 - 3。