免疫荧光法 (IF) 采用抗体和荧光检测来研究固定细胞或组织中靶蛋白的定位、相对表达和激活状态。IF 广泛应用于不同的研究领域。
IF 可用于解答一些疑问,例如:
免疫荧光法包含了很多随时间逐步形成的相关技术。所有这些技术都利用抗体对生物靶标的特异性识别和流式细胞分析中对荧光报告基因的检测。重要的是确保生物标本保存良好,同时抗体可获得靶抗原,但会存在根据样品、靶标和抗体而有所不同的难题。
在本页上,我们汇编了一些资源,以助你操作实验步骤、解答常见疑问,并助你设计成功的 IF 实验。
理想化的 IF 技术/实验步骤会受生物材料类型、样品处理步骤、目标抗原的特性以及所使用的特殊抗体的影响。
考虑事项包括:
最好的抗体可在最低背景下产生具备特异性的强信号。重要的是选择已在你将要使用的应用中进行了验证的抗体。IF 中的抗体验证可包括阳性和阴性表达实验(使用敲除型细胞系、遗传模型、CRISPR 或 RNAi)、靶蛋白定位或翻译后修饰的实验操作和实验步骤优化。
一种抗体的性能根据应用而有所不同。例如,在蛋白质印迹实验中性能良好的一种抗体在 IF 中可能会也可能不会起效。新抗体测试期间,一些抗体会表现出轻微的脱靶结合;我们从不建议将这些抗体用于 IF 或其他非 WB 应用。此外,某种抗体可能在冰冻组织上表现出良好的性能,但在 FFPE 组织上却并非如此,反之亦然。抗体灵敏度和性能可根据固定和处理样品的方式,以及抗体的起效条件而变化。
一旦你决定了在实验中使用哪一类型的生物样品及其制备方法,在 cellsignal.com 上浏览抗体的最简便方法是首先选择相应的应用。然后,你可以输入搜索关键字或选择其他属性(例如宿主、研究领域等),以进一步细化你的搜索,并选择一种已在你所需应用中进行了验证的抗体。
为了让你对自己的实验设计和结果充满信心,并确信你的抗体会如实报告其靶标,阳性和阴性对照实验可提供许多信息。例如:
Cell Signaling Technology (CST) 科学家通常将这些类型的对照作为我们验证流程中的一部分而进行(参见示例)。在你的实验模型系统中设置类似对照是非常值得的,特别在你难以得到满意结果的情况下。
一抗提供靶抗原的特异性检测。二抗根据其来源的物种而结合一抗。兔或小鼠产生的一抗可分别用抗兔或抗小鼠二抗进行检测。
一抗和偶联荧光团的二抗(对一抗的宿主有特异性)的配对称为间接染色。在不使用二抗的情况下使用偶联荧光团的一抗称为直接染色。直接染色法节省时间并可实现对相同宿主产生的抗体进行多重检测。由于多个二抗与单个一抗结合时产生的信号放大,间接染色法通常可提供更高的灵敏度。
也可用这些技术的其他变式,例如使用带有亲和素/链霉亲和素偶联的荧光物质的生物素化一抗。荧光团偶联的 F(ab’)2 二抗片段(Fc 领域缺失)可帮助降低背景。在 mIHC 中采用辣根过氧化物酶 (HRP) 偶联的二抗来催化酪胺-荧光团偶联物沉淀。
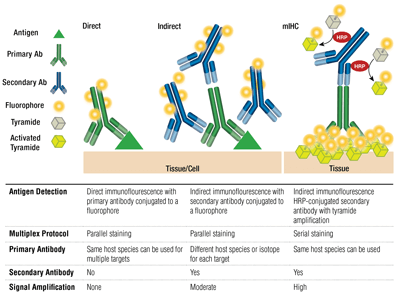
选择抗体和荧光团
多重检测采用通过多个抗体在一次检测中同时对一个以上的靶标进行的检测,以及针对每个靶标的不同波长(颜色)进行的检测。对于间接染色,多重检测的能力取决于荧光团偶联的物种特异性二抗与每种一抗的配对。使用同工型特异性二抗可对源自不同同工型的小鼠抗体进行多重检测,从而实现在一次检测中检测多达 5 个小鼠抗体。对于直接染色,每种一抗应偶联一种不同的荧光团。由于无需顾虑抗小鼠二抗与小鼠组织的非特异性结合,这使我们能够联用源自相同物种/同工型的多种抗体,也使我们能够进行“小鼠-小鼠”染色。
设计多重 IF 实验时,应考虑到荧光显微镜的光谱特性,包括可用的激发源和滤光设置,以避免光谱渗透。现代落射荧光显微镜和共聚焦荧光显微镜通常具有区分 3 个或多个通道的能力。
固定后应用的细胞染料或可固定的活细胞标记可加入到 IF 工作流程中。细胞器标记常用于验证某个靶标的亚细胞定位。经表达的标签(例如 GFP)常用于追踪转染后的细胞或镶嵌实验中;如果 IF 中 GFP 的荧光信号较低,则可应用抗 GFP 抗体。使用染料或荧光蛋白将占据一些荧光通道,从而使抗体可用的通道减少。
这将取决于你可用的激发源和激发/发射滤光功能的光谱特性。在你运行实验前评估荧光团的激发和发射特性以避免荧光渗透。CST 提供各种荧光团偶联的一抗和二抗,包括 Alexa Fluor® 系列染料。
可通过在最佳切割温度 (OCT) 培养基中进行快速冷冻,或通过在石蜡中进行固定和包埋来制备组织切片。可使用恒冷箱来对冷冻样品进行切片,并让其在载玻片上风干 10 至 15 分钟,然后再进行下一步之前的固定。对于 FFPE 组织样品,采集要求、固定和石蜡包埋步骤可根据各组织类型而有所不同。
一般来说,FFPE 组织可提供比 OCT 包埋的冷冻组织更好的形态。这使定量阳性细胞或确定染色剂之间的边界变得更轻松。FFPE 组织还非常稳定;一旦经过包埋,组织块便可储存很多年。这种类型的组织还更易于在实验室之间运输,而且它是人体病理学标本的首选处理方法。
另一方面,FFPE 组织经过一些额外的处理步骤,这些步骤会减少由于蛋白降解而产生的抗原总量、需要修复步骤以检测剩余抗原,并加剧乙醛诱导的自发荧光。除非使用一种丰度较高的蛋白,否则通过间接 IF 难以检测到剩余抗原,并可能需要进行放大以产生一种适用的染色剂。也有可能抗原修复会显露通常无法检测到的抗原,并且会通过其他方式提供预计染色模式的某个抗体可能会产生非特异性染色。同样,还可以使用靶标,其中需要特定的抗原修复方法来检测靶标表位。因此,重要的是考虑验证抗体的方式,以及使用该抗体时需要哪些步骤。
对于 OCT 包埋的冷冻组织,减少处理步骤比形态更重要。由于载玻片在切割组织的同时就已备好可供使用,而且包埋前的处理步骤较少,因此这是获得免疫染色结果的最快方法。蛋白质降解更少,而可供与抗体结合的抗原更多,无需任何其他苛刻的修复步骤。因为这种方法不要求进行放大,所以它对组织质量的灵敏度更高。固定类型(乙醇与乙醛)、持续时间(转录因子等一些靶标需要的固定时间较短)以及组织年龄(尤其是切片后)都非常重要,且会根据靶标而变化。最后,使用冷冻组织可在靶标选择方面提供更多灵活性,因为在切片后可以进行处理,从而在检测设计方面实现更强的个性化。
细胞必须接种在与荧光显微镜兼容的支持材料上。典型的支持材料包括使用聚赖氨酸和/或细胞外基质成分制成以支持黏附细胞培养的玻璃底细胞培养皿、玻璃盖玻片(存放在塑料培养皿内),以及市售的安装在与显微镜兼容的载玻片上的多孔盒。
注意,细胞培养条件可能会影响细胞的健康状态、形态,以及你靶蛋白的表达/定位,并最终决定你 IF 数据的质量。定期检查培养基的 pH 值变化,并在显微镜上以低放大倍数检查细胞应激的迹象(例如多核细胞),以确保你的细胞保持健康状态。还要检查细胞融合度是否适用于该细胞类型和靶标。
理想的固定剂可保留“栩栩如生”的快照,同时通过交联和抑制内源酶来快速阻止自溶降解过程,并且它呈递抗原以供抗体检测。遗憾的是,没有任何一种固定方法可实现采用每种样品和每种抗原都能获得理想效果。甚至相同靶蛋白上的不同抗原都可在不同的实验步骤之间表现出差异。这就是为什么最佳实验步骤不仅可根据样品类型,而且还可根据抗原表位(和抗体)而变化。
现在,对于新鲜的冷冻组织,已冷冻并在恒冷箱内进行了切片的切片应使用固定剂进行处理。或者,也可首先采用穿心灌注或浸泡来对组织样品进行固定,然后在固定后采用冷冻保存步骤以将其保存,随后再进行冷冻和切片。
FFPE 组织处理过程中,如上所述通过用福尔马林(或其他醛基固定剂)浸泡或采用灌注来固定组织,以将其保存,随后进行石蜡包埋和切片。在用抗体进行孵育之前,切片必须进行脱蜡、再水化和抗原修复步骤,以使抗体能够进入样品并结合靶标分子。
在固定前立即用温热而不含蛋白的培养基或 PBS 冲洗细胞可阻止胞外蛋白和碎片沉淀。快速将培养基更换为固定剂溶液,即可完成快速固定。
在以保留结构为主的情况下,最常使用的是甲醛、福尔马林(一种用低比例甲醇溶解甲醛而获得的混合物)和戊二醛等醛基固定剂。对于大多数抗体,CST 建议使用浓度为 4% 的甲醛(不含甲醇)来进行固定。醛类会与细胞蛋白的伯胺类发生反应和交联,并使样品稳定。此外,包括磷酸酶和蛋白酶在内的细胞酶,会通过交联而失活。相比醇类,醛类更能穿透质膜并固定可溶性蛋白,但某些靶标可能会在醛交联中丢失自身的抗原性。
脱水/变性的醇固定剂(如甲醇)会脱去细胞大分子周围的水,导致它们出现原位变性和沉淀。靶蛋白变性会显露隐藏的表位,因此对某些抗体而言这种方法比醛固定更具优势。但脱水固定剂不太适用于可溶性靶标及修饰状态特异性抗体,如磷酸化抗体。参见产品网页,了解最适固定法。
如果使用交联固定剂,则质膜将仍保持完整,这会使胞内靶标无法接触抗体。因此,应在交联固定之后进行通透,除非你的抗体能检测胞外表位。最佳的通透方法会根据抗体而有所不同;始终查看产品页以了解建议实验步骤。
固定后常用 Triton® X-100 进行通透。Triton 和其他去垢剂,如 NP-40、TWEEN®、皂素、洋地黄皂苷和 DOTMAC,可与细胞膜相互作用,从而形成大小不一的“孔”并使抗体能够进入。
或者,也可在固定步骤之后,使用乙醇或甲醇进行醇类通透。这种方法将交联固定剂的快速固定与中间蛋白变性和膜的去脂作用相结合。这可以增强某些靶标的信号,尤其是与细胞器或细胞骨架相关的靶标。
如果你正在使用需要不同 CST 实验步骤的抗体进行多重检测,那么你可能需要确定优先在最佳条件下使用哪一种抗体。此应用说明 (PDF) 中展示了在 mIHC 中进行顺序优化的一个示例。在扩大你的实验前,先进行一次比较不同实验步骤的小型测试可能会获得一些信息。
最常建议是在 PBS + 0.3% Triton® X-100 中加入 5% 正常山羊血清(或产自与二抗相同的物种的血清)。查看数据表以了解建议的封闭试剂。
如果在样品中添加了 Fc 受体,抗体信号将来自特异性靶标检测(通过抗原结合位点/抗体可变区)的混合物,以及结合到 Fc 受体抗体重链的非特异性吸收。动物血清中添加的总 IgG 会封闭 Fc 受体,以阻止一抗和二抗结合,并减少背景噪声。选择荧光团偶联的 F(ab’)2 片段也会避免二抗(但不包括一抗)的 Fc 受体结合
在蛋白质印迹等其他基于抗体的应用中,封闭步骤减少由一抗和二抗与其目的靶标以外的位点的非特异性低亲和结合造成的背景信号。然而,我们发现在 IF 中经过严格测试的重组兔单克隆抗体在很多样品上表现出良好的性能,无论是否进行封闭。最后,选择经免疫荧光法验证的高质量抗体在避免背景噪声方面仍任重道远。
在一个特定的应用中,信噪比 (S/N) 与抗体的特异性和灵敏度有关。可通过比较表达目的靶标的细胞中的荧光强度“信号”与缺乏表达的细胞的“背景噪声”来计算 S/N。如果在过低的浓度下使用抗体,荧光信号将会十分模糊以致无法与背景噪声进行区分。另一方面,浓度过高会导致背景染色,从而使 S/N 下降。始终查看产品数据表以了解建议稀释度,其以抗体验证期间进行的滴定为基础。
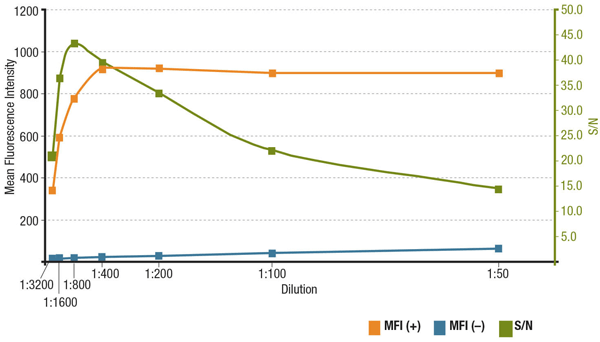
分析 MUC1 (D9O8K) XP® 兔单克隆抗体 #14161 稀释的信噪比。 定量表达(MFI(+),橙色)ZR-75-1 细胞和非表达(MFI(-),蓝色)HCT 116 细胞中,以及计算出的 S/N(绿色)下的平均荧光强度。
一般来说,在 4°C 下过夜孵育可产生强信号。改变孵育时间和温度可改变信号和 S/N。不同抗体可能会根据改变的孵育条件而产生不同反应;如需了解更多,请参见此博客帖子。
可使用任何带有相应激发源和滤光功能的荧光显微镜来进行 IF,包括落射荧光显微镜、扫描显微镜和转盘式共聚焦显微镜。免疫荧光法通常也与一些专门的荧光技术相兼容,包括全内反射荧光 (TIRF)、平面光显微和某些超分辨率技术。
经批准用于 IF-IC 的任何抗体均可用于进行高通量筛选 (HCS) 和高内涵分析 (HCA)。这些实验根据标准 IF 技术而进行,加入了自动化。
你的 IF 实验是否陷入困境?点击此处以获取疑难排解指南。
Cell Signaling Technology、CST 和 XP 均是 Cell Signaling Technology, Inc. 的商标。所有其他商标均属各自所有者专有。