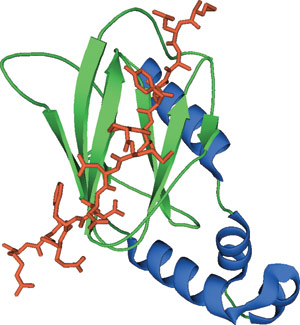
结合 HIFα 羟化脯胺酸肽的 VHL 结构域。
VHL 会与延伸蛋白 C、延伸蛋白 B、Cul2 和 Rbx1 形成复合体,从而构成 E3 泛素-蛋白连接酶,其中 VHL 可作为底物识别亚基。VHL 的 β 结构域约有 100 个氨基酸,并且经证实会与靶蛋白的羟化脯氨酸相互作用。VHL β 结构域中的接触残基在人、苍蝇、青蛙和蠕虫 VHL 同源基因中均非常保守。底物随后被聚泛素化,并被靶向进行蛋白酶体降解。VHL β 结构域经证实会与 HIF-1α 的特定羟化脯氨酸以及 RNA 聚合酶 II 的大亚基相互作用。VHL β 结构域经证实还会与多种非典型的 PKC 同型相互作用。
von Hippel-Lindau 抑癌基因蛋白 (VHL) 的 β 结构域包含一个氨基末端多链 β 夹心和一个通过疏水相互作用紧靠其中一个 β 链的羧基末端 α 螺旋。β 夹心会形成一个部分暴露的疏水核心,这个核心与其他极性残基一起为含羟化脯氨酸肽的配体提供结合位点。VHL 的 Trp88、Tyr98 和 Trp117 与吡咯烷环之间的多种范德华接触以及 His115 与羟化脯氨酸 4-羟化基团之间的氢键会介导这种相互作用。

| VHL 结构域蛋白 | 结合伴侣 |
| Hrs | Hrs FYVE 结构域 |