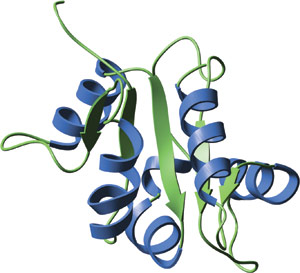
人 TLR2 的 TIR 结构域。
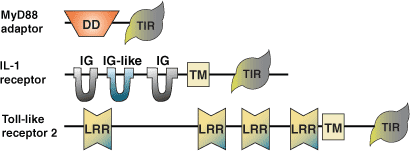
Toll/Il-1 受体 (TIR) 结构域首先因哺乳动物 IL-1 受体 (IL-1R) 与果蝇蛋白 Toll 胞内区域之间的同源性而被发现。后来,在果蝇中检测到 6 种 Toll 样受体 (TLR),在人细胞中检测到 20 多种 TLR 和 IL-1R。同时还检测到含 TIR 结构域的多种接头蛋白。该结构域在 135-160 个氨基酸的核心序列中含有三“盒”保守残基组。介于中间的残基可能有所不同,因为结构域之间的序列保守性仅为 20-30%。两个界面负责介导 TIR 结构域相互作用,这包括受体/接头蛋白低聚化以及受体和接头蛋白的结合。TLR 和 IL-1R 信号转导通路是果蝇和哺乳动物细菌和真菌天然免疫应答的关键介导物。在细菌 LPS、微生物和病毒病原体、细胞因子和生长因子的刺激下,受体和接头蛋白之间的 TIR 结构域相互作用在保守细胞信号转导通路的激活中发挥关键作用。同型和异型相互作用被认为可介导受体信号转导。激活涉及会导致淋巴细胞激活的 NF-κB 释放、免疫球蛋白同种型转换以及细胞因子及其受体的表达。
人 TLR1 和 TLR2 的 TIR 结构域的晶状结构显示,在中央五链平行 β 片层双侧周围共有 5 个螺旋。保守残基位于疏水核心,在由不同 TIR 结构域组成的多个环区域中存在多数插入或缺失。BB 环含有三个高度保守的残基,它从一个较大的保守表面小片段中突出来,并且被认为可介导与含 TIR 结构域的接头蛋白之间的异二聚相互作用。
| TIR 结构域蛋白 | 结合伴侣 |
| TLR4 | 接头蛋白(MyD88、TIRAP、Mal),同型和潜在异型(Toll 样受体)相互作用 |
| MyD88 | Toll 样受体、IL-1 受体,同型和异型(含 TIR 结构域的接头蛋白)相互作用 |
| Mal | TLR4、MyD88、IRAK-2 和同型相互作用 |